Glioblastoma : importante nuova opzione terapeutica approvata negli Usa
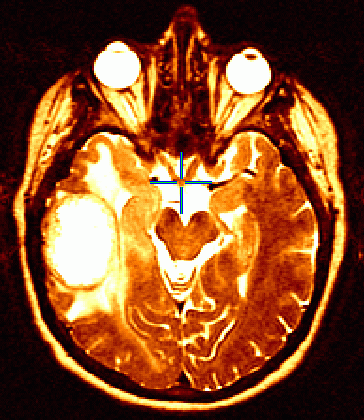
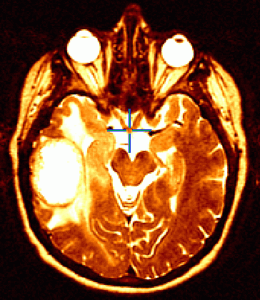
Glioblastoma multiforme
Roche ha annunciato che la Food and Drug Administration (FDA) ha concesso con modalità accelerata l’approvazione di bevacizumab per pazienti affetti da glioblastoma in progressione dopo terapia standard.
La nuova indicazione di bevacizumab è stata concessa secondo il programma di approvazione accelerata della FDA che consente l’approvazione provvisoria di medicinali oncologici o destinati al trattamento di malattie potenzialmente letali ed in seguito al voto unanime del Comitato Consultivo per i Farmaci Oncologici della FDA (ODAC = Oncologic Drugs Advisory Committee), espresso il 31 marzo 2009.
“Per più di un decennio i pazienti affetti da questo tipo di tumore cerebrale non hanno avuto a disposizione nuovi trattamenti – ha dichiarato Timothy Cloughesy, M.D., direttore del Neuro-Oncology Program al Jonsson Comprehensive Cancer Center dell’Università della California, Los Angeles – Dopo così tanti anni con progressi minimi in quest’area, l’utilizzo di bevacizumab è stato in grado dimostrare una risposta duratura del tumore e i medici hanno ora un nuovo farmaco a disposizione per questi pazienti”.
“Tale approvazione non sarebbe stata possibile senza la dedizione di medici, delle associazioni dei pazienti, dell’FDA e soprattutto di coloro che hanno partecipato agli studi clinici e delle loro famiglie, che hanno avuto il coraggio di sostenerli – ha dichiarato William M. Burns, CEO della Divisione Pharmaceuticals di Roche. Un trial mondiale di fase III in pazienti con glioblastoma di nuova diagnosi avvierà presto il reclutamento per approfondire lo studio di bevacizumab in questa malattia”.
La National Brain Tumor Society, un gruppo americano di pazienti, ha accolto con entusiasmo la notizia dell’approvazione accelerata di bevacizumab concessa dalla FDA.
“Una diagnosi di tumore cerebrale è devastante perchè i tumori invadono il tessuto cerebrale e possono provocare un deterioramento rapido della persona – ha dichiarato Harriet Patterson, direttore dei servizi per i pazienti della National Brain Tumor Society. Fino ad ora, i pazienti con recidiva di glioblastoma avevano opzioni terapeutiche quasi nulle e poche speranze”.
In oltre il 90% dei pazienti affetti da glioblastoma, dopo trattamento iniziale con chemioterapia e radioterapia, il tumore si ripresenta ed in questi casi i trattamenti disponibili, una volta che la terapia iniziale non funziona più, non sono efficaci. La sopravvivenza mediana in seguito alla progressione di questo tumore è di circa sei mesi.
L’efficacia di bevacizumab per questa forma aggressiva di tumore cerebrale si basa sul miglioramento del tasso di risposta obiettiva osservato nello studio BRAIN (AVF3708g) e nello studio NCI (NCI 06-C-0064E). Attualmente, non sono ancora disponibili dati di studi clinici controllati randomizzati che dimostrino il miglioramento dei sintomi correlati alla malattia o un aumento della sopravvivenza con bevacizumab nel glioblastoma.
A dicembre 2008 Roche ha richiesto all’EMEA l’autorizzazione per la commercializzazione di bevacizumab come terapia per i pazienti affetti da glioblastoma recidivato dopo terapia standard. Lo studio BRAIN è alla base delle richieste di autorizzazione presentate alle autorità regolatorie di USA e Ue.
L’approvazione accelerata si è basata sulla revisione indipendente dei dati, dello studio BRAIN, uno studio clinico multicentrico, in aperto, non comparativo, di fase II in cui hanno sono stati trattati 167 pazienti affetti da glioblastoma progredito dopo trattamento con temozolomide e radioterapia. I pazienti sono stati randomizzati in due bracci: bevacizumab da solo o bevacizumab in combinazione con irinotecan. L’endpoint primario dello studio era il tasso di risposta obiettiva.
La risposta è stata valutata mediante risonanza magnetica (MRI) e misurata secondo i criteri radiologici di risposta dell’Organizzazione Mondiale della Sanità e in accordo all’uso ridotto o stabile di corticosteroidi. L’MRI infatti non sempre permette la distinzione tra tumore, tumefazione (edema), o morte tissutale (necrosi) provocata dalla precedente radioterapia.
Negli 85 pazienti trattati solo con bevacizumab, lo studio ha dimostrato:
- Nel 26 per cento (95% intervallo di confidenza: 17,0%, 36,1%) dei pazienti si è osservata una riduzione dimensionale del tumore;
- Nel 50% dei pazienti in cui si è osservata la riduzione delle dimensioni del tumore questa si è mantenuta per almeno 4,2 mesi (95% intervallo di confidenza: 3,0 mesi, 5,7 mesi).
Il secondo endpoint co-primario era la sopravvivenza libera da progressione (PFS) per almeno sei mesi; sono state valutate anche la sopravvivenza globale e l’incidenza di effetti collaterali.
L’età mediana dei pazienti trattati con solo bevacizumab è risultata di 54 anni. Il 32% era costituito da donne, l’81% dei pazienti era alla prima recidiva ed il 45% presentava un Karnofsky performance status (KPS) compreso tra 90 e 100 e il 55% tra il 70 e l’80%. I pazienti con emorragia cerebrale attiva sono stati esclusi dello studio.
La maggior parte degli eventi avversi osservati correlati al bevacizumab in questo studio sono risultati simili a quelli riportati precedentemente in altri studi su bevacizumab su altri tumori solidi. Gli eventi avversi riportati più frequentemente in pazienti trattati solo con bevacizumab sono stati stanchezza (45%), cefalea (37%), ipertensione (30%), diarrea (21%) ed epistassi (19%). Sono stati riportati due casi di decesso, nel gruppo di pazienti trattati con solo bevacizumab, la cui correlazione con gli eventi avversi verificatisi è stata considerata possibile.







Salve,
sono la moglie de Cardamone Tonino, affetto da glioblastoma multiforme di IV grado. Gli è stato diagnosticato il 16 giugno 2009 dopo un attacco epilettico. Operato ma, purtroppo è stato possibile asportare solo una piccola parte del tumore, giusto pe effetuare un biopsia. Dopo ciclo di 33 sedute di radioterapia abbinata al Temodal, la risonanza magnetica del 25 novembre 2009 ha evidenziato una leggera diminuzione della massa. Sta condinuando il Temodal ogni 28 giorni e l’ultima risonanza magnetica (del 5 febbraio 2010) ha evidenziato un leggero aumento della massa tumorale. Mio marito si trova su una sedia a rotelle, in quanto a fine agosto, gli si è bloccata tutta la parte destra, ora ha poca reattività motoria. Ha 50 anni e non può sospendere il cortisone (12 mg di soldesam) perchè quando era arrivato ad 1 pasticca di Deltacortene, ha avuto 2 attacchi epilettici ( anche con copertura di 2500 mg di Keppra) e in quel periodo ha sofferto di fortissimi mal di testa ed è stato in uno stato soporifero. Vi prego di contattarci non abbiamo più nulla da perdere, siamo disposti ad effettuare qualsiasi cura sperimentale.
Nella speranza di una vostra risposta vi saluto
Silvia
Abitiamo a Roma.
Buongiorno, mia mamma, 68 anni è stata operata con asportazione del tumore, glioblastoma multiforme di IV grado, da una settimana. Ci propongono un iclo di kemio e radioterapia ma con pochissime speranze. Qualcuno mi può aiutare per provare questa nuova terapia? a chi mi devo rivogere.
Grazie
Ronerto
Firenze