Fibrina e cicatrizzazione
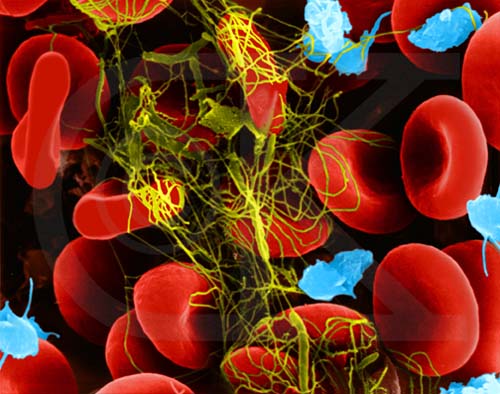
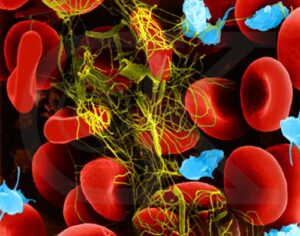
Nel corso della ricerca, si è trovato che in condizioni normali le singole fibre di fibrina sono orientate in modo casuale, mentre sotto stress esse cominciano ad allinearsi nella direzione della sollecitazione. Se quest’ultima non cessa, il coagulo si allunga diminuendo però di volume.
La fibrina è un polimero molto versatile presente nel nostro organismo: da una parte, è fondamentale per la formazione della rete di fibre che costituiscono i coaguli di sangue, necessari per fermare le emorragie. Dall’altra, fornisce un’impalcatura per la formazione dei trombi, che possono ostruire i vasi sanguigni, con gravi conseguenze per la salute.
Ma che cosa conferisce alla fibrina le sue eccezionali qualità? La risposta è tutta nel processo con cui la proteina si “srotola”, perdendo la sua forma tridimensionale originale, secondo le conclusioni di una ricerca della University of Pennsylvania School of Medicine
.
Basandosi su precedenti ricerche sulla fibrina, John Weisel, docente di biologia cellulare e dello sviluppo, e collaboratori hanno studiato le proprietà meccaniche dei coaguli di fibrina sotto stress dalla scala macroscopica fino al livello molecolare, avvalendosi anche di metodi di modellizzazione matematica per l’analisi dei dati sperimentali.
Si è così trovato che in condizioni normali le singole fibre sono orientate in modo casuale, mentre sotto stress esse cominciano ad allinearsi nella direzione della sollecitazione. Se quest’ultima non cessa, il coagulo si allunga diminuendo però di volume.
Proprio questa circostanza è state interpretata come un segno di un processo in atto a livello molecolare, che è stato poi chiarito utilizzando tecniche di spettroscopia X, di microscopia elettronica e di microscopia a forza atomica. Si è infine trovato che la fibrina si “srotola”, perdendo la sua struttura proteica tridimensionale originaria ed esponendo tratti che altrimenti rimarrebbero nelle regioni più interne. Le diverse molecole così possono interagire tra loro con le loro parti idrofobiche, espellendo l’acqua. Ciò permette all’intero coagulo di diminuire di volume di 10 volte quando allungato di tre volte.
“Questa notevole capacità di allungamento della fibrina a livello molecolare permette al coagulo di adattarsi alle diverse condizioni in cui avviene il processo di cicatrizzazione ma anche di essere degradato dagli enzimi opportuni quando non è più necessario”, ha concluso Weisel.