Simeprevir approvato nell’Unione Europea per il trattamento degli adulti con epatite C di genotipo 1 e 4

 Simeprevir fornisce una nuova opzione di trattamento in triplice terapia, oltre a costituire, in associazione con sofosbuvir, il primo regime terapeutico di 12 settimane senza interferone e senza ribavirina, per specifici pazienti in Europa
Simeprevir fornisce una nuova opzione di trattamento in triplice terapia, oltre a costituire, in associazione con sofosbuvir, il primo regime terapeutico di 12 settimane senza interferone e senza ribavirina, per specifici pazienti in Europa
BEERSE, BELGIO 16 maggio 2014 – Janssen-Cilag International NV ha annunciato oggi che simeprevir, il proprio inibitore di proteasi (IP) di nuova generazione ha ottenuto l’autorizzazione all’immissione in commercio da parte della Commissione Europea per il trattamento degli adulti con epatite C cronica (CHC) di genotipo 1 e 4, in associazione ad altri farmaci, ovvero: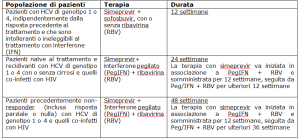
Questa autorizzazione all’immissione in commercio rappresenta un traguardo significativo nello sviluppo di nuove opzioni di trattamento in triplice terapia per i pazienti con epatite C (HCV) di genotipo 1 o 4. Essa include, inoltre, simeprevir come componente di un regime terapeutico interamente orale di 12 settimane di antivirali ad azione diretta (DAA) senza interferone, con o senza ribavirina, rivolto a pazienti con HCV di genotipo 1 o 4, che sono intolleranti o non sono candidabili ad un trattamento con interferone.[i]
“L’approvazione di simeprevir da parte della Commissione Europea è un grande traguardo, in quanto aggiunge una nuova importante opzione terapeutica per i pazienti, continuando a dimostrare la rilevanza della triplice terapia nel trattamento dell’epatite C. Inoltre, l’introduzione dell’unico regime interamente orale di 12 settimane senza interferone, fornisce una nuova opportunità per ottenere una risposta virologica sostenuta nei pazienti con HCV di genotipo 1 o 4, che non tollerano o non sono candidabili a regimi terapeutici a base di interferone.” ha affermato Thomas Stark, Medical Director, Janssen EMEA.
L’epatite C è una malattia che costituisce una rilevante preoccupazione per la salute pubblica a livello mondiale. In Europa si stima siano nove milioni le persone[ii] con infezione da HCV che, se non trattata, può causare gravi danni al fegato, fra cui cirrosi e carcinoma epatocellulare. L’infezione da HCV è la principale causa di trapianto di fegato in Europa.[iii] Sebbene le nuove diagnosi di epatite C siano in calo, dal momento che occorrono circa 20 – 30 anni prima che i sintomi si manifestino, si prevede che tra il 2030 e il 2035 ci sarà un picco di casi di epatite C.[iv],[v]
“Lo scenario del trattamento dell’infezione da epatite C sta evolvendo rapidamente. Simeprevir è un efficace e ben tollerato ampliamento delle nostre terapie contro l’epatite C, ed è un progresso molto apprezzato sia per i pazienti con genotipo 1, sia per quelli con genotipo 4.” Ha commentato il Dottor Andrew Ustianowski, Presidente del British Viral Hepatitis Group e Consulente dell’Infectious Diseases at North Manchester General Hospital.
L’approvazione da parte della Commissione Europea di simeprevir in associazione a interferone pegilato (PegIFN) + ribavirina (RBV) è basata sui risultati ottenuti in un programma di trial clinici che ha compreso tre studi cardine di Fase 3 in oltre 1.000 pazienti. Gli studi QUEST-1, QUEST-2[vi] e PROMISE[vii] hanno valutato simeprevir in associazione a PegIFN +RBV in pazienti naïve al trattamento e in quelli recidivanti dopo una precedente terapia a base di interferone. Tutti e tre gli studi hanno raggiunto i rispettivi endpoint primari e hanno dimostrato che simeprevir, in associazione a PegIFN+RBV, ottiene percentuali di risposta virologica significative rispetto al regime PegIFN+RBV da solo.
L’approvazione da parte della Commissione Europea dell’associazione di simeprevir e sofosbuvir contiene anche i risultati dello studio di Fase 2 COSMOS in pazienti naïve al trattamento. Questo si è basato su pazienti prior null responder e naïve al trattamento.8
Simeprevir
Simeprevir è un inibitore di proteasi NS3/4A, sviluppato congiuntamente da Janssen R&S Irlanda e Medivir AB.
Janssen è responsabile dello sviluppo clinico mondiale di simeprevir e ne detiene i diritti esclusivi di commercializzazione a livello mondiale ad esclusione dei paesi nordici dove Medivir AB conserva tali diritti sull’autorizzazione all’immissione in commercio di Janssen-Cilag International NV.
L’epatite C
L’epatite C è una malattia infettiva veicolata per via ematica seria e complessa, con complicanze epatiche, e costituisce una rilevante preoccupazione per la salute pubblica a livello mondiale. Se non viene trattata, l’epatite C può causare danni importanti al fegato – tra cui cirrosi – che possono portare ad un eventuale trapianto di fegato e possono avere esito infausto. L’epatite C è, infatti, la causa principale di trapianto di fegato in Europa.
Le stime della World Health Organisation (WHO) e dell’Associazione Europea per lo Studio del Fegato (EASL) riportano che nel 2011 il numero delle persone con epatite C cronica nel mondo era pari a 150 milioni9. L’epatite C ogni anno miete 350.0009 vittime nel mondo e 86.000 in Europa.10Poiché, agli esordi, la malattia è spesso asintomatica, è sottodiagnosticata e difficile da trattare. Sino al 90% di coloro che sono colpiti dall’infezione non riescono ad eradicare il virus senza sottoporsi a terapia e l’infezione si cronicizza.11 Secondo le stime della WHO il 20% dei soggetti con epatite C sviluppa cirrosi e, di questi, sino al 20% dei casi evolve in carcinoma epatico.12 Il genotipo 1 del virus dell’epatite C è il più diffuso a livello mondiale13e uno dei più difficili da trattare con successo.
Le Aziende Janssen Pharmaceutical
Noi di Janssen ci dedichiamo ad affrontare e risolvere alcuni dei più importanti bisogni medici insoddisfatti del nostro tempo in diverse aree terapeutiche fra cui oncologia, immunologia, neuroscienze, malattie infettive e vaccini, malattie cardiovascolari e metaboliche. Mossi dal nostro impegno nei confronti dei pazienti sviluppiamo prodotti, servizi e soluzioni innovative per la salute, per aiutare le persone di tutto il mondo.
Per maggiori informazioni potete consultare il sito:www.janssen-emea.com
[i] Olysio SmPC. Accessed March 2014.
[ii]Hatzakis A et. al. The state of hepatitis B and C in Europe: report from the hepatitis B and C summit conference. Journal of Viral Hepatitis, 2011:18,1-16.
[iii] European Association for the Study of the Liver. EASL The Burden of Liver Disease in Europe. Available from http://www.easl.eu/assets/application/files/54ae845caec619f_file.pdf. Accessed April 2014.
[iv]Menzin J et al. BMC Health Services Research 2012; 12(459).
[v]Rein DB et al. Forecasting the morbidity and mortality associated with prevalent cases of pre-cirrhotic chronic hepatitis C in the United States. Abstract Digestive and Liver Disease 2011. Available at: http://www.sciencedirect.com/science/article/pii/S1590865810001702 Accessed March 2014.
[vi] Foster GR et al. Simeprevir (TMC435) with peginterferon/ribavirin for the treatment of chronic HCV genotype 1 infection in treatment-naïve European patients in the QUEST 1 and QUEST 2 Phase III studies. Abstract 1127. Poster presentation at the European Association for the Study of the Liver 2014.
[vii]Forns X et al. The PROMISE study, Simeprevir (TMC 435) with peginterferon/ribavirin for treatment of chronic HCV genotype 1 infection in European patients who relapsed after previous interferon-based therapy. Abstract 013. Oral presentation the European Association for the Study of the Liver 2014.
8 Lawitz M et al. The COSMOS cohort 2 study, abstract presented at European Associate for the Study of the Liver (EASL 2014).
9 World Health Organisation. Hepatitis C Fact Sheet N.164. Available at: htto:/www.who.int/medaicenter/factsheets/fs164/en/ Accessed March 2014.
10 Muhlberger M et al. HCV related burden of disease in Europe: a systematic assessment of incidence, prevalence, morbidity, and mortality. BMC Public Health 2009:9, 34.
11 World Health Organisations (WHO). “Hepatitis C: About HCV Infection”. Ailable at: www.who.int/csr/disease/hepatitis/whocdscrlyo2003/en/index3.html Accessed March 2014.
12 World Health Organisations. Hepatitis C. Available at: http://www.who.int.csr/disease/hepatitis/Hepc.pdf. Accessed March 2014.
13 Zein NN. Clinical Significance of Hepatitis C Virus Genotypes. Clin. Microbiol. Rev. April 2000:13(2), 223-235.