Scoperto il lipide che concorre a scatenare il ‘morbo della mucca pazza’

 Interagendo con la proteina prionica“sana”, il glicolipide GM1 aumenta le probabilità che assuma la forma “tossica”, causa delle encefalopatie spongiformi ed altre malattie neurodegenerative. Lo rivela uno studio dell’Università di Milano-Bicocca pubblicato sulla rivista PLoS ONE.
Interagendo con la proteina prionica“sana”, il glicolipide GM1 aumenta le probabilità che assuma la forma “tossica”, causa delle encefalopatie spongiformi ed altre malattie neurodegenerative. Lo rivela uno studio dell’Università di Milano-Bicocca pubblicato sulla rivista PLoS ONE.
Milano, 18 giugno 2014 – È il glicolipide GM1, un grasso, ad aumentare la probabilità che la proteina prionica nativa (sana) assuma conformazioni alterate irreversibili che causano malattie neurodegenerative come il morbo di Creutzfeldt-Jakob (comunemente noto come “morbo della mucca pazza”) e la sindrome dell’insonnia fatale.
Lo studio, inoltre, conferma le nuove teorie scientifiche, secondo le quali non è sufficiente la sola proteina prionica mutata per generare l’infezione, ma sono necessari dei cofattori, attribuendo al glicolipide GM1 un ruolo chiave di “seme” nella trasformazione della proteina nella sua versione ‘tossica’, denominata Scrapie.
La scoperta è stata realizzata da un gruppo di ricercatori del Dipartimento di Scienze della Salute dell’Università di Milano-Bicocca in collaborazione con l’IRCCS-Istituto di Ricerche Farmacologiche Mario Negri di Milano e il Dipartimento di Scienze Biomediche dell’Università di Padova.
Lo studio (Laura Botto, Diana Cunati, Silvia Coco, Silvia Sesana, Alessandra Bulbarelli, Emiliano Biasini, Laura Colombo, Alessandro Negro, Roberto Chiesa, Massimo Masserini e Paola Palestini, Role of Lipid Rafts and GM1 in the Segregation and Processing of Prion Protein, doi: 10.1371/journal.pone.0098344) è stato pubblicato sulla rivista PLoS ONE.
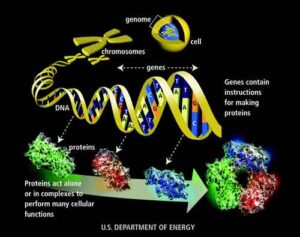
La proteina prionica cellulare (PrPC) è una proteina che si trova nelle cellule del sistema nervoso dei mammiferi all’interno di specifici domini della membrana cellulare, denominati lipid rafts, ricchi di colesterolo e sfingolipidi. La funzione della proteina prionica non è del tutto nota, ma sembra essere importante nella trasmissione dei segnali nervosi. A seguito di un cambiamento della conformazione, la proteina si converte nella “versione” patologica PrPSc (Prion Protein Scrapie): una proteina misfolded, cioè “ripiegata in modo errato”, che corrisponde all’agente che causa le Encefalopatie Spongiformi Trasmissibili (EST): patologie neurodegenerative letali sia per l’uomo che per altri animali. In questa conversione la presenza dei lipidi gioca un ruolo chiave.
Indagando in questo ambito, i ricercatori hanno identificato in un modello cellulare neuronale, un nuovo ruolo per il glicolipide GM1 (un particolare tipo di sfingolipide) nel facilitare la trasformazione della proteina prionica in un pericoloso killer.
La tecnica utilizzata in questo studio, denominata dicroismo circolare, permette di capire se una proteina cambia conformazione in base al grado di assorbimento delleemissioni di luce polarizzata. Osservando lo spettro prodotto, i ricercatori hanno scoperto che l’interazione del glicolipide GM1 con la proteina prionica ne induce un cambio di conformazione: un meccanismo non ancora conosciuto.
«All’inizio di questo lavoro – spiega Paola Palestini, professore associato di Biochimica nell’Università di Milano-Bicocca e coordinatore della ricerca – avevamo molti indizi sul ruolo del glicolipide GM1, ottenuti con tecniche di microscopia confocale e immunoanalisi. Ora, sappiamo che il GM1, interagendo con il prione sano nei lipid rafts, fa aumentare la probabilità di trasformazione in forma “tossica” nel caso di infezione con la proteina prionica misfolded»
Lo studio è stato finanziato da Progetti di Ricerca di Interesse Nazionale (PRIN) e dal Fondo di Ateneo per la Ricerca (FAR).