Ottimi i risultati del Cetuximab nel trattamento dei tumori metastatici del colon-retto


Cetuximab utilizzato in prima linea nei pazienti affetti da tumori metastatici del colon-retto, aumenta in maniera significativa la sopravvivenza
- · I nuovi dati provenienti dallo studio CRYSTAL dimostrano un miglioramento della sopravvivenza totale dei pazienti trattati con Cetuximab – si tratta della prima volta che questo risultato viene ottenuto da un inibitore EGFR
- · Inoltre, i risultati di una meta-analisi mostrano gli evidenti benefici del trattamento con Cetuximab in associazione a FOLFOX o FOLFIRI in termini di sopravvivenza e risposta dei tumori
Berlino/Darmstadt, Germania, 26 Settembre, 2009 – Merck Serono, una divisione di Merck KGaA (Darmstadt, Germania), ha annunciato oggi che Cetuximab ha dimostrato di migliorare significativamente la sopravvivenza totale (OS) quando associato al trattamento standard di prima linea con chemioterapia nei pazienti affetti da tumori metastatici del colon-retto (mCRC) con KRAS non mutato. È la prima volta che viene dimostrato un miglioramento della sopravvivenza totale grazie ad un inibitore del recettore del fattore di crescita epidermico (EGFR) in questa patologia. Questi risultati provengono dall’importante studio CRYSTALa e sono stati presentati al 15° Congresso dell’European Cancer Organization (ECCO), che si svolge questa settimana a Berlino (Germania), congiuntamente al 34° Congresso dell’European Society of Medical Oncology (ESMO) .
“La sopravvivenza totale è un risultato di importanza fondamentale nei tumori metastatici del colon-retto, per cui è estremamente soddisfacente raggiungere questo obiettivo per la prima volta con una terapia mirata per l’EGFR associata alla chemioterapia standard” ha commentato il Professor Eric Van Cutsem, responsabile dello studio CRYSTAL e Professore di Medicina e Oncologia dell’apparato digerente dell’University Hospital Gasthuisberg a Leuven, in Belgio. “Siamo felici di essere i primi a dimostrarlo con Cetuximab – un risultato che può potenzialmente allungare in maniera significativa la vita dei pazienti affetti da tumori con KRAS non mutato”.
Dati CRYSTAL sulla sopravvivenza totale
Nei pazienti con tumori con KRAS non mutato che assumono Cetuximab in associazione a FOLFIRI:
- La OS mediana era di 23,5 mesi rispetto ai 20,0 mesi di quelli trattati con la sola chemioterapia (hazard ratio [HR] 0,796; p=0,0094)
- Il rischio di progressione della malattia è stato ridotto del 30% (HR 0,70; p=0,0012)
- La probabilità di ottenere una risposta del tumore si è complessivamente raddoppiata (RR 57,3% vs. 39,7%; p<0,0001)1
Dati OPUS sulla sopravvivenza totale
I risultati senza precedenti dello studio CRYSTAL vengono ulteriormente rafforzati dai nuovi dati provenienti dallo studio OPUS, anch’essi presentati oggi, che mostrano:
- La OS mediana nei pazienti affetti da tumori con KRAS non mutato era di 22,8 mesi nel gruppo di pazienti trattati con chemioterapia in associazione a Cetuximab e di 18,5 mesi nel gruppo trattato con la sola chemioterapia (HR 0,85; p=0,39)2
Questi dati sulla sopravvivenza totale sono stati presentati insieme ad una meta-analisi degli studi CRYSTAL e OPUSb, che ha evidenziato i miglioramenti in numerosi parametri importanti dei pazienti affetti da tumori metastatici del colon-retto (mCRC) trattati con Cetuximab in associazione alla chemioterapia.
Meta-analisi CRYSTAL/OPUS
La meta-analisi è stata disegnata per valutare la OS, la sopravvivenza libera da progressione della malattia (PFS) e la percentuale di risposta (RR) nelle popolazioni CRYSTAL e OPUS combinate, composte da pazienti affetti da tumori con KRAS non mutato (n=482). Tale analisi ha dimostrato che, in relazione all’insieme di tali popolazioni:
- Il rischio di morte si è ridotto del 19% (HR 0,81; p=0,0062) per i pazienti trattati con Cetuximab più chemioterapia rispetto a quelli trattati con la sola chemioterapia
- Il rischio di progressione della malattia si è ridotto del 34% (HR 0,66; p<0,0001) per i pazienti trattati con Cetuximab più chemioterapia rispetto a quelli trattati con la sola chemioterapia
- La probabilità di ottenere una risposta nei pazienti trattati con terapia combinata è più che raddoppiata rispetto a quelli trattati con la sola chemioterapia (tasso di probabilità [OR] 2,16; p<0,0001)1
“Cetuximab – ha concluso il Dr. Wolfgang Wein, Executive Vice President Oncology della Merck Serono – rappresenta la prima ed unica terapia mirata che ottiene un miglioramento significativo in termini di sopravvivenza se usata in combinazione con le chemioterapie standard FOLFOX e FOLFIRI come trattamento di prima linea dei pazienti affetti da mCRC con KRAS non mutato”.
Tumore del colon-retto
Si stima che ogni anno in Europa. Più di 370.000 persone siano colpite da un tumore al colon- retto, cifra pari al 13% dell’incidenza totale dei tumori, e che ne muoiano circa 200.000.3 Circa il 25% dei pazienti si presenta alla diagnosi con una patologia metastatica.4 Per i pazienti colpiti da tumore del colon-retto, il tasso di sopravvivenza a cinque anni risulta solo del 5%.
aCRYSTAL: Cetuximab combined with iRinotecan in first line therapY for metaSTatic colorectAL cancer
bOPUS: OxaliPlatin and cetUximab in firSt-line treatment of mCRC
Bibliogragia
- Van Cutsem E, et al. ECCO/ESMO Congress 2009. Abstract No: 6077.
- Bokemeyer C, et al. ECCO/ESMO Congress 2009. Abstract No: 6079.
- Parkin DM, et al. CA Cancer J Clin 2005;55:72–108.
- Cunningham D, et al. Eur J Cancer 1993;29A(15):2077–2079.
- Macdonald JS. CA Cancer J Clin 1999;49(4):202–219
Informazioni su Cetuximab
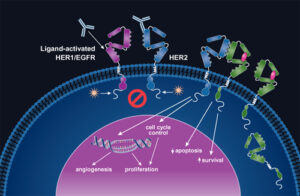
Cetuximab è un anticorpo monoclonale IgG1 di prima classe e ad ampia azione, indirizzato all’EGFR, il recettore del fattore di crescita epidermico. Come anticorpo monoclonale, la modalità di azione di Cetuximab si distingue dai trattamenti chemioterapici standard non selettivi in quanto si indirizza in modo specifico e si lega all’EGFR. Il legame inibisce l’attivazione del recettore ed il successivo processo del segnale di trasduzione, che comporta la riduzione sia dell’invasione dei tessuti normali da parte delle cellule tumorali sia l’espansione del tumore a nuovi siti. Si ritiene inoltre che inibisca l’attività sia delle cellule tumorali di riparare al danno causato dalla chemio e radioterapia e di inibire la formazione di nuovi vasi sanguigni all’interno dei tumori, che si traduce nel portare ad una globale soppressione della crescita tumorale.
L’effetto collaterale più comune con Cetuximab è uno sfogo epidermico simile all’acne che sembra essere correlato ad una buona risposta alla terapia. In circa il 5% dei pazienti, reazioni di ipersensibilità possono comparire durante il trattamento con Cetuximab: circa la metà di queste reazioni è di grado severo.
Cetuximab ha già ottenuto l’autorizzazione alla commercializzazione in 77 Paesi. E’ stato approvato per il trattamento del tumore del colon-retto metastatico in 77 Paesi e per il trattamento del tumore della testa e del collo a cellule squamose (SCCHN) in 72 Paesi:
- Dicembre 2003 (Svizzera), febbraio 2004 (Stati Uniti d’America), giugno 2004 (Unione Europea) e in seguito dagli altri Paesi: per l’uso in associazione con l’irinotecan nei pazienti con un tumore metastatico del colon retto (mCRC, metastatic colorectal cancer) esprimenti l’EGFR che hanno fallito la terapia con irinotecan. Inoltre, Cetuximab è stato anche approvato come agente singolo in altri pesi.
- Aprile 2006 (Unione Europea) e in seguito altri Paesi: per l’uso in associazione con la radioterapia per il trattamento del tumore localmente avanzato della testa e del collo a cellule squamose (SCCHN). In altri paesi, Cetuximab è anche approvato come monoterapia nei pazienti con un tumore SCCHN recidivante e/o metastatico che hanno fallito la terapia con chemioterapia.
- Luglio 2008 (Unione Europea): l’autorizzazione è stata aggiornata per il trattamento dei pazienti che esprimono il recettore del fattore di crescita epidermico (EGFR), nel tumore mCRC con KRAS non mutato e come agente singolo nei pazienti che hanno fallito la terapia basata su oxaliplatino e irinotecan e che sono intolleranti all’irinotecan.
- Luglio 2008 (Giappone): per l’uso in associazione con irinotecan nei pazienti con tumore mCRC che esprime l’EGFR e che hanno fallito la precedente terapia con irinotecan
- Novembre 2008 (Unione Europea): l’autorizzazione è stata ampliata all’uso in associazione con la chemioterapia a base di platino nei pazienti colpiti da SCCHN recidivante e/o metastatico.
Merck ha acquisito il diritto alla commercializzazione di Cetuximab fuori dagli Stati Uniti e dal Canada da ImClone Systems, una filiale totalmente di proprietà della Eli Lilly and Company, dal 1998. In Giappone, ImClone Systems Incorporated, Bristol-Myers Squibb Company e Merck sviluppano e commercializzano congiuntamente Cetuximab. Merck è attivamente impegnata nell’avanzamento dei trattamenti in oncologia e sta studiando nuove terapie in aree specialistiche, quali l’uso di Cetuximab nel tumore del colon retto, della testa e del collo a cellule squamose e al polmone non a piccole cellule. Merck ha inoltre acquisito i diritti per un trattamento per il tumore a base di tegafur-uracile – un chemioterapico orale somministrato con acido folinico (FA) per il trattamento di prima linea del tumore al colon-retto metastatico.
In campo oncologico, inoltre, Merck sta studiando l’uso del vaccino BLP25 liposoma nel trattamento del tumore al polmone non a piccole cellule. Il vaccino ha ottenuto lo status fast track nel Settembre 2004 da parte dell’FDA. Merck ha ottenuto una licenza esclusiva a livello mondiale da Oncothyreon Inc., Bellevue, Washington, USA.
Inoltre, Merck sta sviluppando la cilengitide, che è la prima di una nuova classe di terapie anti-tumore investigazionali chiamate inibitori di integrina a raggiungere la fase III di svilupo; la cilegintide è attualmente studiata per il trattamento di glioblastoma, il SCCHN e il NSCLC. Gli inibitori di integrina sono studiati per colpire il tumore e la sua vascolarizzazione.
Informazioni su Merck Serono
Merck Serono è la divisione per farmaci da prescrizione innovativi di Merck, gruppo globale farmaceutico e chimico.. Merck Serono, con sede centrale a Ginevra, Svizzera, scopre, sviluppa, produce e commercializza piccole molecole innovative e farmaci biologici per aiutare pazienti affetti da patologie che non hanno ancora una risposta adeguata. Negli Stati Uniti e in Canada, EMD Serono opera separatamente attraverso affiliate incorporate.
Merck Serono dispone di prodotti all’avanguardia per patologie come cancro, sclerosi multipla, infertilità, disordini endocrini e cardiometabolici.
Con un investimento annuale in Ricerca & Sviluppo di un miliardo di euro, Merck Serono è impegnata a far crescere il proprio business sia in aree terapeutiche specialistiche come patologie neurodegenerative, Oncologia, Fertilità ed Endocrinologia, sia in nuove aree terapeutiche, a seguito dell’attività di ricerca sulle malattie autoimmuni ed infiammatorie.
Per maggiori informazioni, consultare il sito www.merckserono.it
Informazioni su Merck
Merck è una società globale farmaceutica e chimica con vendite per 7,6 miliardi di Euro nel 2008, una storia iniziata nel 1668 ed un futuro formato da circa 33.000 dipendenti in 60 Paesi. Il suo successo è caratterizzato dall’innovazione da parte di dipendenti imprenditori. Le attività operative di Merck sono svolte sotto il coordinamento della Merck KgaA, nella quale la famiglia Merck detiene una partecipazione del 70% ed altri azionisti il rimanente 30%. Nel 1917 la succursale negli Stati Uniti Merck & Co è stata espropriata ed è divenuta da allora in poi una società indipendente.