Malattia di Krabb: nuove strategie dalle terapia genica
All’Istituto San Raffaele-Telethon di Milano, primo successo del trattamento di questa malattia genetica del sistema nervoso nel modello murino: più vicina la sperimentazione sull’uomo-
Ideata una nuova strategia di terapia genica per la malattia di Krabbe, una grave patologia genetica che colpisce il sistema nervoso: grazie alla terapia genica con cellule staminali emopoietiche un team internazionale di ricercatori diretto da Luigi Naldini presso l’Istituto San Raffaele-Telethon per la terapia genica (Hsr-Tiget) di Milano è riuscito per la prima volta a trattare la malattia nel modello animale.
L’importante risultato è riportato sulle pagine di Science Translational Medicine*, la nuova rivista edita dal prestigioso giornale scientifico internazionale dedicata alle ricerche traslazionali, fortemente improntate cioè al trasferimento “dal bancone del laboratorio al letto del paziente”.
Come spiega Alessandra Biffi, condirettore dello studio con Luigi Naldini, «la malattia di Krabbe, chiamata anche leucodistrofia a cellule globoidi, è una malattia da accumulo lisosomiale che colpisce in età infantile e ha un decorso rapidamente progressivo e sempre fatale. La malattia è ereditaria ed è dovuta a difetti nel gene per la galattocerebrosidasi (GALC), enzima deputato allo smaltimento di alcune componenti della mielina, il rivestimento isolante dei nervi essenziale per la conduzione degli impulsi nel sistema nervoso centrale e periferico. Se l’enzima è difettoso, viene meno il ricambio naturale di queste sostanze, che si accumulano così nei lisosomi (le strutture normalmente deputate allo smaltimento dei rifiuti cellulari) e diventano tossiche per la mielina. Ne risulta un progressivo arresto dello sviluppo psicomotorio dei bambini colpiti, che perdono anche le capacità motorie e cognitive già acquisite».
Purtroppo ad oggi non esiste alcuna terapia capace di prevenire o arrestare il decorso della malattia, nè di reintegrare le funzioni perse. In alcuni casi si può rallentare la progressione della malattia effettuando un trapianto di cellule staminali ematopoietiche (cellule madri di tutti gli elementi del sangue) provenienti da un donatore sano prima della comparsa dei sintomi (quindi entro i primi 4 mesi di vita).
Non sempre, però, è disponibile un donatore compatibile; inoltre questo tipo di trapianto presenta il rischio di rigetto da parte dell’organismo verso le cellule staminali del donatore. Continua Biffi: «la nostra esperienza in altre patologie analoghe ha dimostrato che si può rendere il trattamento più efficace e meno rischioso correggendo geneticamente le cellule staminali ematopoietiche del paziente stesso. Per farlo si sfruttano dei particolari vettori virali (detti lentivirali) che consentono di ottenere nelle cellule del paziente una produzione superiore al normale del gene terapeutico (GALC in questo caso), in assenza di rischi legati alla incompatibilità tra donatore e ricevente del trapianto».
Questo approccio, basato sulla possibilità di utilizzare le cellule mature del sangue – derivate delle cellule staminali ematopoietiche trapiantate – come veicolo per trasportare l’enzima funzionante nel sistema nervoso affetto, è stato già applicato con successo dai ricercatori dell’Hsr-Tiget a modelli pre-clinici di altre malattie da accumulo lisosomiale ed è attualmente oggetto di uno studio clinico in corso su pazienti affetti da leucodistrofia metacromatica.
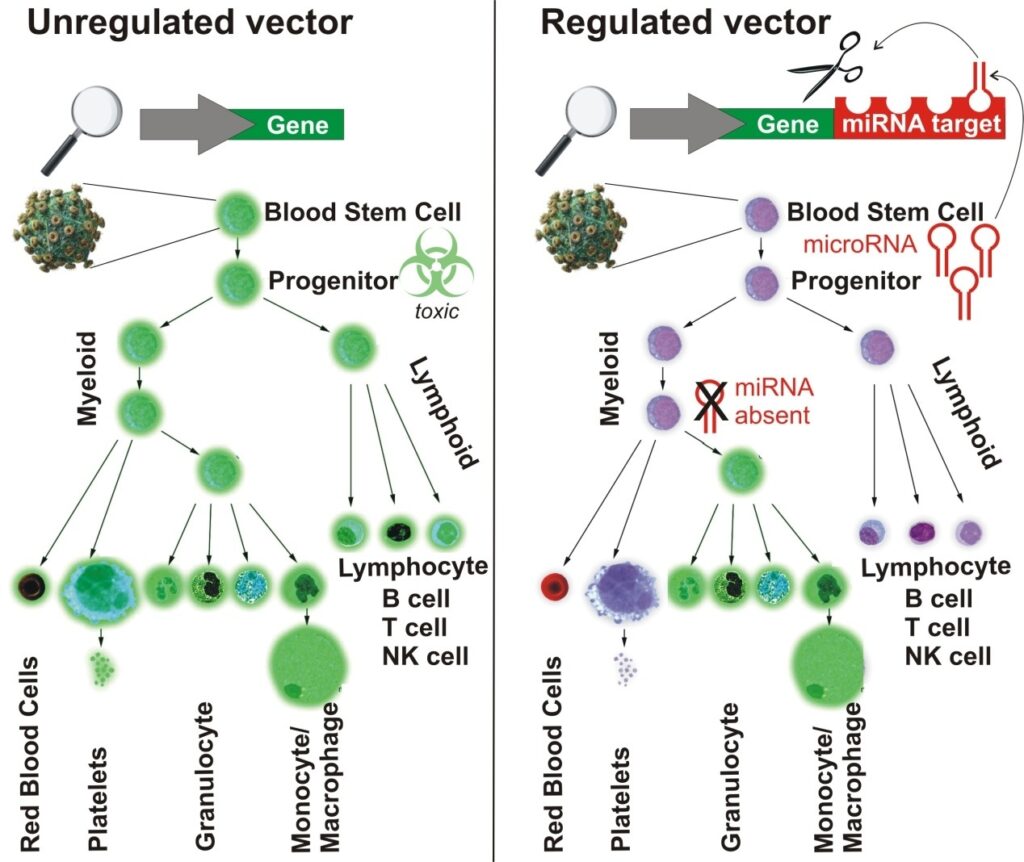
Finora, però, non era stato possibile applicarlo anche alla malattia di Krabbe perché, come spiega Naldini «ci siamo imbattuti in una inattesa tossicità dell’enzima GALC per le cellule staminali del sangue, cosa che invece non si verificava nella loro progenie differenziata. Abbiamo allora ideato una nuova strategia per regolare l’espressione del gene terapeutico, che deve essere inserito nelle cellule staminali per garantirne il mantenimento a lungo termine e la trasmissione a tutta la loro progenie, ma non vi deve esprimere il suo prodotto. Per questo ci siamo serviti dei microRna, piccoli elementi regolatori dell’espressione di altri geni. Ogni micro-Rna può “spegnere” l’espressione di una batteria di altri geni che riconosce attraverso una sorta di “codice a barre” impresso sul loro messaggio».
Grazie a un nuovo metodo messo a punto proprio da loro per visualizzare l’attività dei microRna in singole cellule viventi, i ricercatori dell’Hsr-Tiget hanno cercato quali fossero selettivamente espressi nelle rare cellule staminali del midollo osseo e non nella loro progenie in corso di differenziamento. Hanno così identificato per la prima volta dei microRna specifici per le cellule staminali ematopoietiche e inserito il codice a barre riconosciuto da uno di questi microRna in un vettore lentivirale per la terapia genica della malattia di Krabbe, che in questo modo risulta sensibile al silenziamento da parte del microRna.
«Anche se il vettore viene inserito nelle cellule staminali, il gene terapeutico si può esprimere soltanto nella loro progenie matura, dopo che il microRna si è spento» spiega ancora Naldini
«Il trapianto di queste cellule geneticamente corrette nel modello animale di malattia di Krabbe, che presenta una forma molto simile a quella umana, «ha migliorato in modo significativo le condizioni di vita e la sopravvivenza degli animali trattati. In particolare, questo approccio di terapia genica si è dimostrato più vantaggioso rispetto al trapianto tradizionale da donatore sano. Inoltre, la nostra strategia è promettente non solo per la cura del malattia di Krabbe, per cui intendiamo passare a una sperimentazione clinica sui pazienti non appena avremo concluso gli altri studi preclinici necessari – prevedibilmente tra 2 anni -, ma anche perché permette di rendere più efficace e sicura la terapia genica basata su cellule staminali ematopoietiche in molte altre malattie genetiche».






