Biosimilari e Governance: i provvedimenti di Campania e Toscana

 Insieme nel favorire l’utilizzo dei farmaci biosimilari per assicurare il risparmio sanitario regionale e garantire nuove risorse all’innovazione terapeutica
Insieme nel favorire l’utilizzo dei farmaci biosimilari per assicurare il risparmio sanitario regionale e garantire nuove risorse all’innovazione terapeutica
Roma, 24 marzo 2011 – Organizzato da Assogenerici, oggi a Roma, un Convegno sui modelli di governance delle Regioni in materia di biosimilari. Tra i temi del dibattito, la verifica sulle delibere già adottate dalla Toscana e dalla Campania, e l’intento di fornire spunti per la definizione di una normativa nazionale, su cui dibatte la Commissione Sanità del Senato.
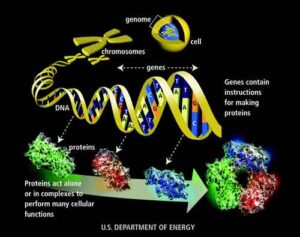
I Giudici Amministrativi si sono espressi a favore dei biosimilari, disponendo che un biosimilare (molecola ottenuta con la tecnica di ingegneria genetica – tecnologia del Dna ricombinante – prodotta utilizzando cellule o microrganismi geneticamente modificati in modo da poter produrre sostanze normalmente non riproducibili in laboratorio), nonostante non possa essere considerato allo stato attuale come un generico, non è un farmaco inferiore rispetto all’originator.
Le Regioni Campania e Toscana, supportate dalle evidenze dell’Agenzia Europea per i Medicinali (EMA), in termini di qualità, sicurezza ed efficacia del prodotto, e dalle recenti pronunce del Consiglio di Stato hanno intrapreso due percorsi diversi, ma che vedono nei farmaci biosimilari un’opportunità per ottenere un sistema sostenibile di governance della spesa sanitaria regionale.
La Campania, conseguentemente alle disposizioni dell’EMA (l’efficacia, la sicurezza e la qualità dei farmaci biosimilari, per specifica indicazione terapeutica, è pari a quella dei farmaci di riferimento) e dell’AIFA (per i pazienti mai trattati in precedenza o naive non si giustifica alcuna prudenza prescrittiva in merito ai requisiti di sicurezza ed efficacia) ha emanato due provvedimenti (Decreto 15/2009 e 44/2010), al fine di favorire l’uso dei farmaci biosimilari per un obiettivo di risparmio medio per costo terapia di almeno il 40%.
I Giudici Amministrativi stabiliscono che in ogni gara pubblica, nei processi di acquisto di farmaci biotecnologici, gli acquirenti hanno l’obbligo di esplicitare le ragioni tecniche da cui desumere la non fungibilità sul piano terapeutico del prodotto “originator” con quello “biosimilare” e quelle logiche, eventualmente basate sulla necessità di garantire la continuità terapeutica per i pazienti già in trattamento (cfr. ordinanza Tar Lombardia, n. 653/2010, in senso conforme, ordinanza Consiglio di Stato n. 4125/2010, ordinanza Tar Puglia – Lecce, n. 120/2011).
In merito alle eccezioni avverse alla delibera della Regione Toscana, il Tar ha confermato come nei processi di acquisto di farmaci biotecnologici bisogna garantire sia l’esigenza concorrenziale attraverso una gara pubblica con confronto competitivo tra i vari produttori, sia la continuità terapeutica per i pazienti già in trattamento e, infine, la libera scelta del medico di prescrivere un farmaco diverso da quello risultato aggiudicatario della gara, qualora esigenze specifiche lo richiedano (cfr. Tar Toscana, sentenze nn. 6702-6703/2010).
“L’uso del generico equivalente e del biosimilare consente di generare risorse per l’innovazione: è oggi di dominio pubblico che i farmaci biologici sono e saranno sempre più utilizzati per il trattamento di patologie invalidanti e rischiose per la vita del paziente, come ad esempio la sclerosi laterale amiotrofica (conosciuta come SLA o morbo di Lou Gehrig)” afferma Giorgio Foresti, presidente di Assogenerici, “e il trattamento di tali patologie ha un costo elevatissimo e sarà accessibile ai molti pazienti affetti solo quando si provvederà a razionalizzare la spesa introducendo i farmaci biosimilari”.