Il funzionamento degli enzimi: tutti i riflettori puntati sull’argomento
Il nostro mondo è unico in quanto gli organismi viventi possono subire reazioni chimiche complesse in modo rapido e preciso, e sequenziarle insieme. Ma come possono le proteine integranti della vita accelerare queste reazioni? Ricercatori provenienti dalla Francia forniscono nuovi indizi su come realmente funzionano gli enzimi. Lo studio viene presentato sulla rivista PLoS Biology.
Gli scienziati dell’Institut des sciences du végétal (IVS) presso il Centre national de la recherche scientifique (CNRS), in Francia, in collaborazione con i colleghi del Laboratoire de chimie et biochimie pharmacologiques et toxicologiques (LCBPT), dell’Institut de biochimie et biophysique moléculaire et cellulaire (IBBMC) e il Laboratoire de cristallographie et RMN biologique, hanno studiato il legame di un composto con proprietà terapeutiche per il suo bersaglio biologico.
Gli esperti dicono che determinate macromolecole catalizzano reazioni biochimiche e possono essere riutilizzate più volte. La questione è, tuttavia, se queste proteine sono in grado di accelerare le reazioni. Quello che i ricercatori sanno è che l’enzima deve prima riconoscere il substrato, che viene poi in contatto con alcuni gruppi chimici per lui specifici ed è infine trasformato. In seguito il substrato è favorito dall’ambiente chimico che si instaura, ed è legato alle deformazioni di gruppi molecolari fisicamente vicini tra loro nello spazio, stando ai ricercatori.
L’assemblaggio macromolecolare raggiunge quindi uno stato effimero che è altamente reattivo e che gli esperti chiamano “stato di transizione”. Il risultato è che la reazione biochimica viene accelerata da un fattore di diverse centinaia di miliardi.
La ricerca degli anni cinquanta ha rivelato il modello di “aggiustamento indotto”, che vede il coinvolgimento del substrato nel cambiamento della forma dell’enzima. Qui, il piccolo composto inizialmente interagisce con l’enzima, e questa interazione provoca il cambiamento della forma della macromolecola, che a sua volta consente la trasformazione del substrato.
In questo ultimo studio, i ricercatori hanno usato un enzima bersaglio terapeutico, indagando su un piccolo composto simile al substrato che potrebbe legarsi fortemente con l’enzima, bloccando la sua attività e rivelando le sue proprietà antibiotiche, antineoplastici e diserbanti.
Il team afferma che è necessaria una fase di “aggiustamento indotto” per garantire un legame efficace del composto con l’enzima bersaglio. In poche parole, è il composto minuscolo che determina la modificazione conformazionale, una volta collegato all’enzima.
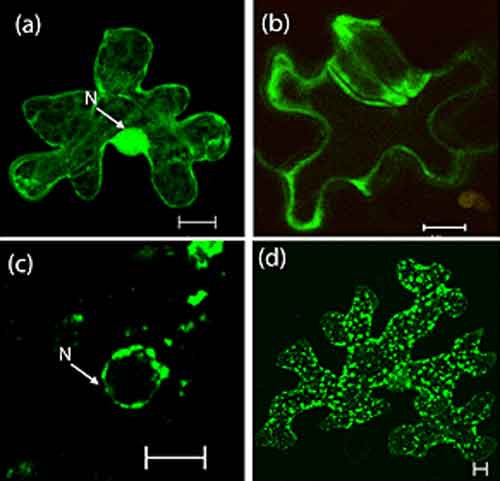
Derivando la risoluzione della struttura fine di questo enzima dalla pianta Arabidopsis thaliana, i ricercatori hanno illustrato in modo efficace le interazioni e le conformazioni di ogni enzima e substrato, in ogni fase della reazione.
Si forma un legame idrogeno, stabilizzando il complesso enzima-substrato nello stato di transizione. In questo modo la reazione di idrolisi enzimatica può avvenire in modo efficiente.
Grazie ai loro risultati, i ricercatori ritengono che questo modello possa essere utilizzato su tutte le forme di enzima, in particolare quelle che si trovano nei batteri, che sono bersagli degli antibiotici. Essi dicono che i dati mostrano anche il meccanismo di come una molecola terapeutica può legarsi al suo bersaglio, “separandola” da esso, e quindi estendendo l’effetto del farmaco oltre il trattamento vero e proprio.
I risultati di questo studio possono contribuire agli sforzi dei ricercatori di sviluppare o migliorare le proprietà farmacologiche di candidati farmaci.
Per maggiori informazioni, visitare:
PLoS Biology:
http://www.plosbiology.org/home.action
Institut des sciences du végétal (IVS):
http://www.isv.cnrs-gif.fr/