Actine e miosine: scienziati risolvono il rebus
Ricercatori provenienti da Germania e Stati Uniti sono riusciti a scoprire come i filamenti di miosina e actina lavorano insieme per regolare i muscoli e altri processi motori. Hanno fornito un’immagine delle proteine tropomiosina e troponina che controllano quanta miosina si lega all’actina. I risultati di questo studio potrebbero aiutare i ricercatori a determinare come le modifiche determinate geneticamente influenzano il complesso actina-miosina-tropomiosina in alcuni tipi di malattie cardiache ereditarie.
Hanno fornito un’immagine delle proteine tropomiosina e troponina che controllano quanta miosina si lega all’actina. I risultati di questo studio potrebbero aiutare i ricercatori a determinare come le modifiche determinate geneticamente influenzano il complesso actina-miosina-tropomiosina in alcuni tipi di malattie cardiache ereditarie.
Coordinato da Stefan Raunser ed Elmar Behrmann dell’Istituto Max Planck di Fisiologia molecolare in Germania, il team ha generato un’immagine precisa del complesso actina-miosina-tropomiosina fino a 0,8 nanometri usando sofisticate tecniche di microscopia elettronica. L’immagine rappresentava una risoluzione di meno di un milionesimo di millimetro. Non era mai stato fatto prima.
Grazie a questo studio, i ricercatori hanno potuto identificare correttamente la posizione delle proteine all’interno del complesso e analizzare i processi di contrazione muscolare.
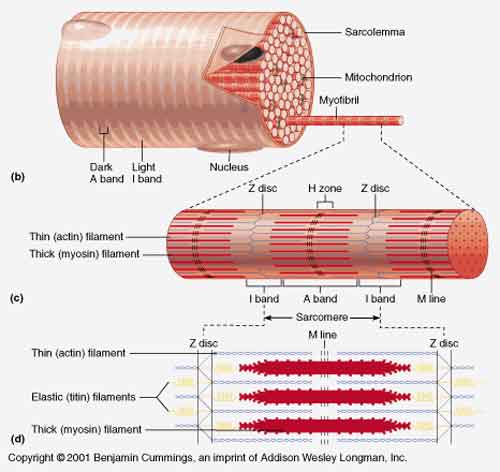
Il sarcomero, un’unità muscolare di base, comprende le proteine actina, miosina e tropomiosina. La contrazione di un muscolo significa che la miosina deve scivolare lungo le molecole filamentose di actina. La tropomiosina, insieme alla troponina, controlla la contrazione dei muscoli regolando quando la miosina si lega all’actina, spiegano i ricercatori. Il punto del legame per la miosina sul filamento di actina è bloccato dalla tropomiosina e dalla troponina in stato di riposo, hanno detto.
“La testa della miosina è in una posizione a 90 gradi,” hanno detto i ricercatori. “Solo dopo un afflusso di calcio, che si aggancia alle proteine regolanti, il punto di legame sul filamento di actina è esposto. La testa della miosina si aggancia a questo punto, cambia la sua conformazione e si piega in maniera articolata, tirando così anche l’actina.” I filamenti scivolano l’uno sull’altro, portando a un sarcomero più corto e alla contrazione muscolare.
“È un passo importante per la comprensione dell’interazione tra le single proteine all’interno delle strutture funzionali del muscolo,” ha detto il dott. Raunser. “Dobbiamo, per così dire, disegnare una mappa per i biochimici. Le nostre scoperte renderanno loro più facile capire i processi e le sequenze degli eventi che si verificano nei muscoli.”
I risultati saranno di aiuto anche ai medici specialisti, che cercano di spiegare il cattivo funzionamento del cuore, di solito legato a mutazioni puntiformi. “Trovare il punto esatto delle mutazioni è fondamentale per sviluppare cure per queste malattie cardiache,” ha detto il dott. Raunser.
Hanno contribuito a questo studio ricercatori della Facoltà di medicina della Ruhr-Universität Bochum in Germania e dell’Università del Texas negli Stati Uniti.
Per maggiori informazioni, visitare:
Istituto Max Planck di Fisiologia molecolare:
http://www.mpi-dortmund.mpg.de/english/Start/Welcome/index.html
Facoltà di medicina di Hannover:
http://www.mh-hannover.de/index.php?L=1