Epatite C: al vaglio dell’EMA l’immissione in commercio del Daclatasvir
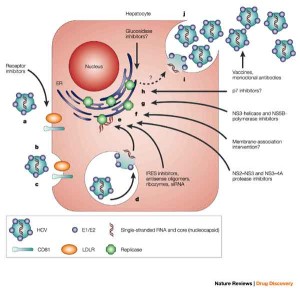
Bristol-Myers Squibb ha annunciato che l’Agenzia Europea dei Medicinali (EMA) ha validato la richiesta di autorizzazione all’immissione in commercio (MAA, Marketing Authorization Application) per l’utilizzo di daclatasvir (DCV), un inibitore sperimentale del complesso NS5A, per il trattamento di pazienti adulti con epatite C cronica (HCV) con malattia epatica compensata, che include i genotipi 1, 2, 3 e 4.
La richiesta mira all’approvazione di daclatasvir per l’uso combinato con altri farmaci, incluso sofosbuvir, per il trattamento dell’epatite C cronica. La validazione della MAA segna l’inizio di un processo di revisione regolatoria accelerata per DCV, che ha il potenziale, quando utilizzato in combinazione con altri farmaci, di colmare una grande necessita’ medica non soddisfatta nell’ambito dell’Unione Europea (UE), dove si stima che 9 milioni di persone siano affette da epatite C. 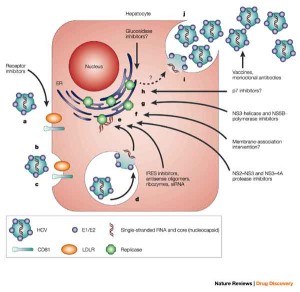 “Il nostro vasto programma di studi clinici ha dimostrato che daclatasvir ha un potenziale utilizzo come farmaco di base in regimi di trattamento multiplo dell’HCV – afferma Brian Daniels, MD, senior vice president del Global Development and Medical Affairs, Research and Development di Bristol-Myers Squibb -. Se daclatasvir verra’ approvato, ci impegneremo per assicurarne la disponibilita’ a pazienti con opzioni terapeutiche limitate e collaboreremo con le autorita’ sanitarie dell’UE per assicurare che l’accesso al farmaco sia ottenuto il piu’ velocemente possibile”.
“Il nostro vasto programma di studi clinici ha dimostrato che daclatasvir ha un potenziale utilizzo come farmaco di base in regimi di trattamento multiplo dell’HCV – afferma Brian Daniels, MD, senior vice president del Global Development and Medical Affairs, Research and Development di Bristol-Myers Squibb -. Se daclatasvir verra’ approvato, ci impegneremo per assicurarne la disponibilita’ a pazienti con opzioni terapeutiche limitate e collaboreremo con le autorita’ sanitarie dell’UE per assicurare che l’accesso al farmaco sia ottenuto il piu’ velocemente possibile”.