I telomeri: le nostre clessidre biologiche. Contengono “scritta” la condanna all’invecchiamento
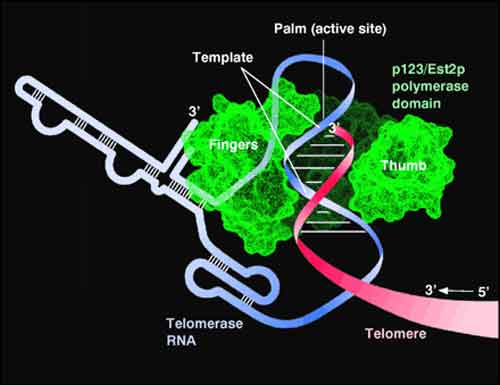
I telomeri sono le nostre “clessidre” cellulari. Nel 2009 gli studi su di loro fruttarono il premio Nobel, e si parlò di corsa all’elisir dell’eterna giovinezza.
MILANO – Ogni singola cellula del nostro corpo è inesorabilmente condannata a invecchiare e, prima o poi, a spegnersi. Una dura legge che la natura ha marchiato a fuoco sul Dna e in particolare nei telomeri, le estremità terminali che proteggono i cromosomi. Queste sequenze funzionano come “clessidre” cellulari, una specie di timer della vita: a ogni ciclo di proliferazione della cellula i telomeri perdono un pezzettino, mano a mano che si accorciano la cellula invecchia, e quando il tempo li ha consumati significa che è arrivata al capolinea. Frenare questa progressiva erosione è una delle strade battute dalla scienza a caccia dell’elisir di eterna giovinezza, ma ora uno studio guidato dall’Ifom di Milano spiega che invecchiare è un destino ineluttabile. Gli autori hanno dimostrato che accorciarsi non è l’unica cosa che può accadere ai telomeri.
Il problema vero è che, a differenza di tutto il resto del Dna, quello dei telomeri non si può riparare. Se si rompe o si danneggia, non è prevista soluzione. La scoperta, pubblicata su Nature Cell Biology, sancisce in sintesi “l’inevitabilità delle lesioni del tempo”, riassumono i ricercatori. Lo studio è condotto da Marzia Fumagalli e Francesca Rossiello sotto la guida di Fabrizio d’Adda di Fagagna, che all’Ifom (Istituto Firc di oncologia molecolare) è responsabile del programma di ricerca ‘Telomeri e senescenza’. Al lavoro hanno collaborato colleghi dell’università di Milano-Bicocca e della New Jersey Medical School americana. Le conclusioni del team hanno implicazioni anche nella lotta al cancro. Infatti, se da un lato la senescenza segna il deterioramento di tutta una serie di funzioni vitali, a livello cellulare è anche un meccanismo che, attivato precocemente, può prevenire l’insorgenza dei tumori.
Quando, il 5 ottobre del 2009, gli studi sui telomeri fruttarono il Nobel per la Medicina agli statunitensi Elizabeth H. Blackburn, Carol W. Greider e Jack W. Szostak, i media celebrarono l’evento come un premio alla scienza che insegue l’immortalità. Si parlò di corsa all’elisir di eterna giovinezza perché l’idea era che, agendo sull’enzima che regola la lunghezza dei telomeri (la telomerasi), sarebbe possibile rallentare o addirittura invertire la marcia dell’invecchiamento. Il nuovo studio descrive invece un quadro più complesso, in cui l’accorciamento non è il solo nemico dei telomeri: “Con l’età – precisa infatti d’Adda di Fagagna – abbiamo riscontrato un accumulo progressivo di danni in queste porzioni cromosomiche in cellule e tessuti, indipendentemente dal loro accorciamento”.
La scoperta milanese si può riassumere così: le nostre cellule non leggono il passare del tempo solo dalla ridotta lunghezza dei telomeri, ma anche dalla compromessa integrità di questi ‘cappucci’ sui cromosomi. E l’integrità dei telomeri, più della loro lunghezza, è il parametro chiave in particolare per le cellule che hanno smesso di dividersi, ad esempio i neuroni. Anche se le cellule non proliferanti non perdono i telomeri, infatti, invecchiano comunque. Allo stesso modo, frenare l’accorciamento dei telomeri non significherebbe automaticamente riuscire a restare giovani. E questo perché bisognerebbe fare i conti anche con l’irreparabilità di eventuali danni al Dna di queste seguenze.
“Che il Dna si rompa è un evento tutt’altro che raro nella vita della cellula – sottolinea d’Adda di Fagagna. Al contrario, si potrebbe dire che il materiale genetico è sotto attacco praticamente di continuo. Senza considerare eventi straordinari come l’esposizione a radiazioni o a diversi agenti chimici e fisici, le minacce vengono dalle stesse attività vitali della cellula”. Anche il solo fatto di “respirare significa produrre specie reattive dell’ossigeno, i cosiddetti radicali liberi, che possono rompere la doppia elica di Dna”. Ma così come la struttura che custodisce il ‘codice della vita’ viene costantemente danneggiata, viene anche costantemente riparata.
“Le cellule – ricorda lo scienziato – reagiscono alla presenza di lesioni accendendo una serie di allarmi molecolari, proteine che scoprono il Dna danneggiato e innescano una cascata di reazioni che porta alla risoluzione del problema. Osservando attentamente le cellule dopo eventi di danneggiamento, però, ci siamo accorti che in alcuni punti del genoma rimanevano accesi i caratteristici allarmi, senza che le lesioni venissero riparate”.
Utilizzando tecnologie genomiche all’avanguardia, l’èquipe dell’Ifom è riuscita a mappare all’interno del patrimonio genetico le aree da cui partivano questi allarmi ‘inceppati’. “Abbiamo localizzato le zone incriminate, scoprendo che nelle punte dei cromosomi i danni al Dna rimangono irrisolti”, spiegano Fumagalli e Rossiello, autrici degli esperimenti presso il campus milanese.
Ma se riparare il Dna rotto è vitale per la cellula, perché esistono sequenze impossibili da aggiustare? Perché l’evoluzione non le ha eliminate? “Riparare consiste nel mettere assieme o fondere estremità separate di Dna – risponde d’Adda di Fagagna – Se queste estremità sono parti interne di un cromosoma, allora l’evento di riparo è un bene fondamentale per la sopravvivenza della cellula. Se invece a essere scambiate per estremità da riunire fossero le parti terminali dei cromosomi, si avrebbe una fusione anomala tra cromosomi, che metterebbe a rischio la stabilità e l’organizzazione dell’intero genoma. Proprio perché hanno il compito di proteggere i cromosomi, i telomeri sono stati selezionati dall’evoluzione in modo da non poter essere riparati. Si può dire che “l’irreparabilità in caso di danno è il prezzo che pagano per non correre il rischio di fondersi”.
Lo studio dell’Ifom è finanziato tra gli altri, oltre che da Embo (Organizzazione europea di biologia molecolare) e Telethon, da Airc (Associazione italiana per la ricerca sul cancro), Firc (Fondazione italiana per la ricerca sul cancro) e Aicr (Associazione per la ricerca internazionale sul cancro). Infatti, invecchiamento cellulare e tumori sono collegati a doppio filo e a dimostrarlo è stato proprio il team di d’Adda di Fagagna nel 2006: evocare precocemente la senescenza, quando un oncogene si attiva e minaccia di innescare la cascata di eventi che porta al tumore, è un’arma che la cellula ha a disposizione per bloccare l’invasione incontrollata della neoplasia. Mentre quando questo sistema fallisce, l’avanzata del cancro diventa inevitabile. “Considerando queste connessioni tra senescenza e cancro – conclude lo scienziato – stiamo proseguendo le ricerche per comprendere se, e in che modo, i danni irreparabili che si accumulano nei telomeri siano in relazione con l’azione degli oncogeni durante la trasformazione tumorale e durante i tentativi della cellula di contrastarla”.
Repubblica.it






