Rene policistico: precocità e aggressività della malattia scritta nel DNA
Individuata la mappa genetica che mette in relazione il tipo di mutazione con l’aggressività e la precocità della malattia
Prevedere l’evoluzione e l’aggressività della malattia attraverso l’analisi dei geni mutati. E’ questo, in estrema sintesi, il risultato ottenuto da uno studio dell’IRCCS Ospedale San Raffaele di Milano che ha indagato le caratteristiche genetiche del rene policistico. I risultati sono stati pubblicati dalla rivista Scientific Reports.
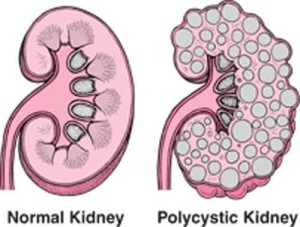
Il rene policistico è una delle malattie genetiche più comuni ed è la prima causa genetica di insufficienza renale al mondo. Soltanto in Italia ne soffrono oltre 60mila persone. Recentemente è stato approvato il primo farmaco specifico per questa patologia, che andrà a sostituire i farmaci fino ad oggi utilizzati per contenere il dolore cronico associato.
Al momento niente arresta però il progressivo peggioramento della condizione che può portare a insufficienza renale, dialisi e trapianto dell’organo. Di fronte a una malattia al contempo così diffusa e dal meccanismo molecolare così complesso, la ricerca è l’unica via percorribile.
Attraverso il sequenziamento del Dna di oltre 400 persone affette da rene policistico in tutta Italia, i ricercatori hanno costruito per la prima volta una mappa che mette in relazione il tipo di mutazione genetica all’aggressività e alla precocità della malattia.
È ormai noto che il rene policistico è dovuto alla presenza di mutazioni nei geni PKD1 o PKD2, tuttavia non tutte le mutazioni sono uguali: a seconda del tipo di mutazione, le istruzioni contenute nel gene possono essere più o meno compromesse e le proteine prodotte seguendo queste istruzioni risultano più o meno disfunzionali. Questo fa sì che il rene policistico sia una malattia molto eterogenea, che si presenta a diverse età e che peggiora con velocità differenti. Ecco perché il lavoro coordinato da Paola Carrera, genetista molecolare e parte del gruppo di ricerca di Maurizio Ferrari, direttore del Laboratorio di Biologia Molecolare Clinica del San Raffaele, è così importante: perché costituisce un database di informazioni che permetterà di riconoscere meglio le varianti della malattia dal tipo di mutazione, migliorando i test genetici e offrendo terapie personalizzate.
«Il nostro lavoro getta le basi per comprendere meglio la malattia, migliorare i test genetici e indirizzare i pazienti verso strategie di prevenzione e di terapia più efficaci», spiega Paola Carrera.
Delle 701 mutazioni dei geni PKD1 e PKD2 che lo studio pubblicato associa alla malattia, solo 249 erano già note: 452 sono mutazioni osservate per la prima volta e che i ricercatori hanno classificato in base al grado di patogenicità.
L’obiettivo finale è costruire dei test genetici che non si limitino a dare una risposta binaria – sì/no – sul futuro esordio della malattia, ma siano in grado, sulla base del tipo di mutazione genetica riscontrata nel singolo paziente, di fornire indicazioni più dettagliate sull’età d’esordio, l’aggressività della malattia e la capacità di rispondere a determinati trattamenti.