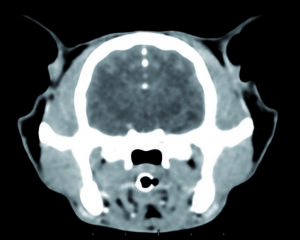
Malattia di Huntington: nuovo trattamento affidato ad un farmaco ‘orfano’
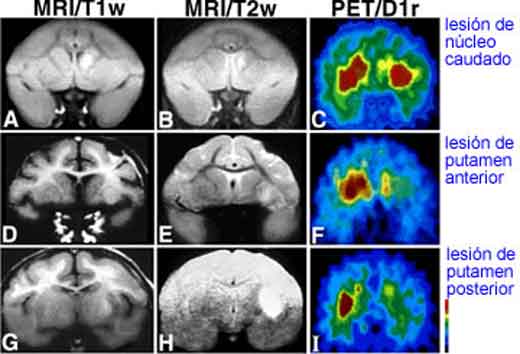
 L’Agenzia Europea di Valutazione dei Medicinali (EMEA) e l’ente regolatorio americano Food and Drug Admnistration hanno concesso alla molecola SEN14196 la designazione di “farmaco orfano” per il trattamento della malattia di Huntington.
L’Agenzia Europea di Valutazione dei Medicinali (EMEA) e l’ente regolatorio americano Food and Drug Admnistration hanno concesso alla molecola SEN14196 la designazione di “farmaco orfano” per il trattamento della malattia di Huntington.
Il composto, un inibitore potente e selettivo della Sirtuina 1 (SirT1), per somministrazione orale, è attualmente in studio clinico di Fase 1 a dosaggio singolo e multiplo, con disegno randomizzato, in doppio cieco, controllato con placebo, per valutarne sicurezza, tollerabilità e farmacocinetica in un totale di 96 volontari sani. Gli studi di Fase II inizieranno entro il 2010.
Nell’Unione Europea, dopo l’autorizzazione all’immissione in commercio, la designazione di Farmaco Orfano dà diritto a un’esclusiva di mercato di dieci anni, oltre che all’eleggibilità per supporto alla predisposizione dei protocolli e possibilità di esenzione o riduzione di alcuni costi registrativi. L’Orphan Drug Act in vigore negli Stati Uniti d’America fornisce, analogamente, una serie di incentivi economici e regolatori all’azienda sponsor degli studi clinici. Tra questi: riduzione di alcune tariffe regolatorie, assistenza alla predisposizione dei protocolli ed eleggibilità per una esclusiva di mercato di sette anni.