il centro Nerviano Medical Sciences riceve l’approvazione dall’FDA sulla sperimentazione sull’uomo di un nuovo farmaco antitumorale
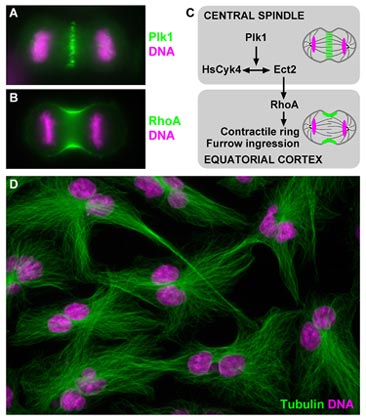
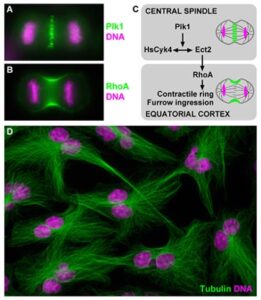
(A) Localization of Plk1 to the central spindle and (B) accumulation of RhoA at the cleavage furrow during anaphase in human cells. (C) Model depicting Plk1 function in triggering the initiation of cytokinesis. (D) Tetraploid and bi-nucleated interphase cells as a result of acute Plk1 inhibition and cytokinesis failure during the preceding cell division.
Nerviano, 13 maggio 2009. – Nerviano Medical Sciences ha ricevuto l’approvazione dall’FDA per la sperimentazione clinica di un nuovo farmaco antitumorale da testare per la prima volta, sull’uomo. Si tratta di una molecola che inibisce PLK-1, una proteina chiave per la proliferazione cellulare. Il prodotto blocca la divisione delle cellule tumorali provocandone la morte. Il nuovo inibitore della proteina PKL-1 è un farmaco mirato che ha dimostrato, in fase preclinica, di essere attivo sia nei tumori solidi che in quelli ematologici.
La molecola rappresenta il primo inibitore di PLK-1 selettivo disponibile per uso orale. «Si tratta della seconda approvazione FDA per l’avvio di fasi cliniche nei primi cinque mesi dell’anno di prodotti NMS: infatti, in gennaio, l’FDA aveva approvato l’entrata in clinica per un’altra molecola della pipeline NMS, l’inibitore di cdc7, per il quale, in aprile, sono già iniziati i trattamenti sui primi pazienti» – spiega il Dr. Francesco Colotta, Direttore Ricerca e Sviluppo di NMS. «Ora anche per questo nuovo farmaco inizierà il reclutamento dei pazienti in centri clinici negli Stati Uniti. La rapidità con cui l’FDA ha approvato l’inizio degli studi clinici con l’inibitore di PLK-1 rappresenta un ulteriore riconoscimento della qualità e dell’innovazione espressa dalla ricerca italiana e in particolare del centro di Nerviano».
L’inibitore di PLK-1 si aggiunge alla pipeline di nuove molecole antitumorali generate da NMS ed attualmente in sviluppo clinico e che includono l’inibitore di Aurora (Danusertib) in fase II e l’inibitore di CDK e l’inibitore CDC7 entrambi in fase I.
http://ilgiorno.ilsole24ore.com